El 28 de marzo de 2015 el Instituto Favaloro realizó el primer trasplante cruzado de riñón en Latinoamérica. Tal vez muchos lo recuerden porque involucró al periodista Jorge Lanata, pero los economistas que estudiamos diseño de mercados lo recordamos como el primer paso para introducir esta modalidad de trasplantes en Argentina y, tal vez, en todo Latinoamérica. En Argentina, esto se concretó el 12 de octubre de 2017: por medio de una resolución publicada en el Boletín Oficial, el Incucai (Instituto Nacional Central Único Coordinador de Ablación e Implante) fue autorizado a incorporar este tipo de operaciones.
¿Qué es el trasplante cruzado de riñón?
Los pacientes que sufren de falla renal tienen dos opciones de tratamiento: diálisis o trasplante. En Argentina en 2017, 29.346 pacientes recibían diálisis y había 11.148 pacientes en la lista de espera para trasplante renal. Antes de la ley, había en Argentina dos opciones de trasplante: riñón de un donante cadavérico o uno vivo. En caso de provenir de un donante vivo, este debería estar relacionado al paciente vía un vínculo familiar, y si dicho vínculo no existiese, se podía apelar a un proceso judicial para autorizar el trasplante.
Desde el punto de vista médico, hay dos consideraciones importantes. La primera es que, comparado a un trasplante cadavérico, un trasplante de un donante vivo está asociado a una mejor calidad de vida para el receptor. La segunda es que un paciente no puede recibir cualquier riñón; entre las muchas compatibilidades que tienen que existir entre el paciente y el donante, las más salientes son la compatibilidad sanguínea y la de tejido.[1]
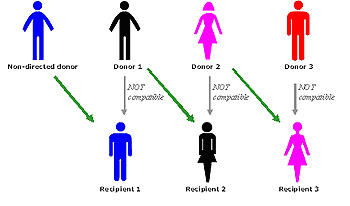
El trasplante cruzado es una modalidad que permite que un paciente que tiene un potencial donante vivo no compatible aun así reciba un trasplante vivo. Fue introducida en un paper de Rapaport[2] en 1986 e implementada por primera vez en Corea del Sur en 1990. Como ejemplo, supongamos que una paciente, Ana, tiene tipo sanguíneo A y su donante, Bernardo, tiene tipo sanguíneo B, mientras que otra paciente, Bárbara, tiene tipo sanguíneo B y su donante, Alejandro, tiene tipo sanguíneo A. Ninguna de las pacientes puede recibir el riñón de su donante; bajo la ley anterior, deberían permanecer en la lista de espera hasta recibir un trasplante cadavérico. El trasplante cruzado de riñón permite que Ana reciba el riñón de Alejandro y Bárbara el de Bernardo; no se desperdician los riñones de los donantes vivos y los pacientes reciben un órgano de mejor calidad que el que recibirían en la lista de espera.
Bajo el marco legal anterior, hubiese sido muy difícil que Ana y Bárbara reciban trasplantes de donantes vivos. Primero, hubiese requerido que Ana y Bárbara se conozcan, sepan cada una del potencial donante de la otra, y, fundamentalmente, confíen en que ambas partes van a realizar el intercambio. Segundo, un juez debería haber aprobado que Ana y Bárbara reciban un riñón de un donante vivo no relacionado; en 2014, de los 378 trasplantes con donante vivo, solo 13 fueron con donante no relacionado. De hecho, el trasplante de Jorge Lanata fue producto de este alineamiento de estrellas.
El nuevo marco legal crea un sistema donde pacientes con sus donantes vivos no compatibles pueden inscribirse y se encarga de encontrar los pares compatibles. En nuestro ejemplo, Ana y Bárbara podrían no conocerse (incluso vivir en distintas provincias) y aun así el intercambio podría realizarse. Además, la ley remueve el requerimiento de pasar por un juez y establece las reglas bajo las cuales el intercambio se produce.
¿Qué podemos aprender de experiencias previas y en qué podemos innovar?
Si bien Argentina es el primer país en Latinoamérica en aprobar el trasplante cruzado de riñón como una modalidad de trasplante, esta modalidad tiene largo tiempo en el mundo: Corea del Sur realizo el primer trasplante cruzado en 1990; en 1999, Suiza condujo el primero en Europa; en 2000, comenzó en Estados Unidos, donde se estima que el 13% de los trasplantes de riñón ocurren de acuerdo a esta modalidad. En Estados Unidos, fueron médicos y economistas los que impulsaron la creación de centros de trasplante cruzado. De hecho, el centro de trasplante cruzado de New England fue fundado por Dr. Delmonico y el economista Al Roth. Este último recibió el premio Nobel de Economía en 2012, en parte por las implicaciones prácticas de su trabajo para el diseño de estos sistemas. En consecuencia, Estados Unidos ha estado en la vanguardia de la innovación en esta modalidad: la investigación de economistas como Al Roth, Tayfun Sönmez, y Utku Ünver, entre otros, ha sido fundamental en el desarrollo y la implementación del trasplante cruzado.
Dado el estado incipiente del proyecto en Argentina, es un buen momento para reflexionar sobre qué podemos aprender de los proyectos existentes, tanto para imitarlos como para innovar sobre ellos:
- ¿Quiénes pueden ser donantes? En Argentina, la ley sigue insistiendo en que los pares receptor-donante (en nuestro ejemplo, Ana-Bernardo y Bárbara-Alejandro) tengan un vínculo familiar para poder inscribirse en el “Programa de Donación Renal Cruzada”. Si bien la mayoría de las veces las parejas receptor-donante poseen un vínculo familiar, esta restricción limita las posibilidades de encontrar un intercambio exitoso. Entre otras cosas, esta restricción no prevé la posibilidad de donantes altruistas: personas que se inscriben en el sistema para ser donantes vivos pero no acompañan a un receptor. En la práctica, la presencia de donantes altruistas ha permitido implementar, además de trasplantes cruzados, también cadenas. En una cadena, el donante altruista da su riñón al receptor de una pareja no compatible, cuyo donante luego da su riñón a otra pareja no compatible, etc. La diferencia entre las cadenas y el trasplante cruzado es que no es necesario cerrar el ciclo. Hay dos modalidades de cadenas.
- En el Domino Chain, el donante de la última pareja dona su riñón a alguien en la lista de espera.
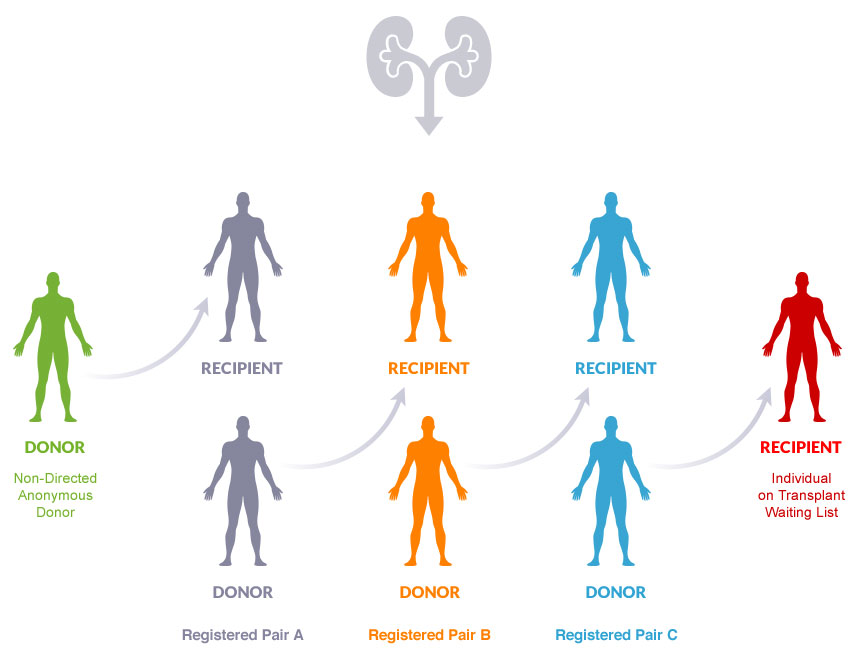
(Imagen crédito: https://blood.ca/sites/default/files/kidney-donor-domino-effect.jpg)
- En Never Ending Altruistic Donation, el donante de la última pareja queda anotado en el sistema. Si fuese necesario que la cadena continue (porque se anota alguien que requiere un donante vivo) se le requerirá que done su riñón.
(Imagen crédito: http://www.nationalkidneycenter.org/wp-content/uploads/2011/11/Illustration4.jpg)
La razón para requerir que el último receptor tenga un potencial donante es para evitar situaciones donde alguien es beneficiado sin devolver al sistema.
- Compatible pairs:[3] La ley prevé que sólo parejas donante-receptor que son incompatibles pueden participar del programa. Esto no tiene en cuenta el beneficio de incluir parejas que son compatibles. Por un lado, permitiría llevar a cabo más intercambios. Como ejemplo, pensemos en Ana, una paciente de tipo sanguíneo A, y Osvaldo, su donante, de tipo sanguíneo 0. Supongamos que existe otro paciente, Oscar, de tipo sanguíneo 0, con su donante, Alejandra, de tipo sanguíneo A. En este caso, Alejandra no puede donarle su riñón a Oscar (grupo sanguíneo A no puede donar a grupo sanguíneo 0), mientras que Ana y Osvaldo no pueden participar pues son compatibles. Por lo tanto, sólo podríamos llevar a cabo el trasplante entre Ana y Osvaldo. Si Ana y Osvaldo pudiesen participar del sistema, podríamos concretar dos donaciones: Alejandra a Ana y Osvaldo a Oscar. Además, esto podría ser beneficioso para Ana: si Alejandra tiene mejor compatibilidad en edad y peso con Ana que la que tiene con Osvaldo, la expectativa de vida de Ana es ahora mejor. En la medida que diseñemos un sistema que no perjudique a los pacientes en pares compatibles (por ejemplo, ofreciéndole al paciente participar de intercambios con donantes de mejor calidad que el suyo), el sistema puede generar un mayor número de donaciones y de mejor calidad.
- Conexión con la lista de espera: En Argentina, la ley permite a las parejas inscriptas en el programa de donación cruzada tener a su receptor también inscripto en la lista de espera para un trasplante cadavérico mientras esperan que otra pareja les sea asignada. Supongamos que un receptor inscripto en ambos sistemas recibe una oferta de trasplante cadavérico. Como un trasplante de donante vivo es muy superior en calidad a uno cadavérico, es posible que el receptor quiera declinar esta oferta y mantener sus opciones abiertas. Por un lado, queremos darle esa libertad para que pueda obtener el mejor resultado posible y potencialmente usar su donante para otra operación; por el otro lado, si no hay una penalidad por rechazar la oferta, aumenta el tiempo de espera de los pacientes en ambas listas.
Al momento de escribir este artículo, la nueva ley no menciona qué ocurre en el caso de que un paciente inscripto en ambos sistemas decline una oferta de trasplante cadavérico. Las reglas que implementemos van a determinar los incentivos de los receptores a aceptar o declinar estas ofertas; estos incentivos luego determinan qué tipo de asignaciones de órganos podemos implementar. De hecho, entender esta interacción entre las reglas que determinan la asignación de ofertas en la lista de espera después de declinar una oferta y las asignaciones que podemos implementar tanto en la lista como en el programa de donación cruzada fue el foco del primer capítulo de mi tesis de doctorado. Si bien allí estudio maneras en las cuales diseñar estas reglas, el mensaje principal es el siguiente: si permitimos que un receptor rechace una oferta de trasplante cadavérico sin ninguna consecuencia pueden haber grandes costos en términos de eficiencia para los otros pacientes en ambos sistemas.[4] Esto nos pone ante la siguiente disyuntiva. Una opción es repensar el sistema de trasplantes, tanto el cadavérico como el cruzado, de manera conjunta en vez de como dos sistemas independientes. La segunda opción es pensar cómo determinar la prioridad dentro de la lista de espera de trasplantes cadavéricos de los pacientes que están en ambos sistemas. Dado que estos pacientes tienen más opciones que los que sólo se encuentran en la lista de espera, tratarlos del mismo modo implícitamente perjudica a los que tienen menos opciones. Cuando hay múltiples listas para asignar objetos similares, los economistas sabemos muy poco sobre como diseñar las prioridades de los participantes anotados en múltiples listas a modo de garantizar la eficiencia en la asignación. Este es uno de los temas que ocupa mi investigación actual.
[1] Otras son ausencia de cross match positivo donante-receptor, ausencia de un antígeno no deseado en el donante, diferencia de edad menor o igual a 20 años, diferencia de peso menor o igual a 30% entre el paciente y el donante.
[2] Rapaport FT. The case for a living emotionally related international kidney donor exchange registry. Transplant Proc 1986; 18: 5–9
[3] https://www.kidneyregistry.org/compatible_pairs.php?cookie=1.
[4] Doval, L. A Theory of Stability in Dynamic Matching Markets (2014). Working paper, California Institute of Technology